選択的RET阻害薬のセルペルカチニブが2021/12/13に日本でも使えるようになりました。
100人検査して2人しか見つからない遺伝子異常です。
50人検査して49人目まで見つからなかったら、その後は検査をする気持ちが萎えてしまうかもしれません。
しかし、私の義父のようにその2%にあたった患者にとっては、まさに福音です。
これまで義父は、一次治療、二次治療、三次治療と、その年齢と体力からすると十分に頑張ったといえる治療をこなしてきて、はっきりした効果は得られないまでもどうにか診断から1年を凌いできました。
いよいよもう後がない、もはやこれまでか、という局面で、ようやく四次治療でセルペルカチニブが使えるようになりました。
製薬会社から提供されたパンフレットに沿って、RETそのものについて、また薬事承認の裏付けとなったLIBRETTO-001試験の概要と結果に触れます。

 正常なRET遺伝子に由来する蛋白質はEGFRなどと同じく受容体型チロシンキナーゼで、リガンドが結合すると二量体を形成し、細胞内シグナル伝達系を介して細胞増殖を促すとされます。腎臓や腸管神経系の派生や神経組織、神経内分泌組織、造血系などの組織の維持に関わる働きを持つそうです。
正常なRET遺伝子に由来する蛋白質はEGFRなどと同じく受容体型チロシンキナーゼで、リガンドが結合すると二量体を形成し、細胞内シグナル伝達系を介して細胞増殖を促すとされます。腎臓や腸管神経系の派生や神経組織、神経内分泌組織、造血系などの組織の維持に関わる働きを持つそうです。 

一方、RET遺伝子の複製過程で偶然発生したRET融合遺伝子は、リガンドが結合せずとも二量体を形成して細胞質内に局在し、恒常的に細胞増殖を促し、細胞をがん化へ導きます。

セルペルカチニブ(商品名レットヴィモ)は、RET蛋白質のアデノシン三リン酸(ATP)結合部位に、ATPと競合的に結合することで、細胞内シグナル伝達、細胞増殖刺激を抑制します。

国立がん研究センターで肺腺がん患者319人のドライバー遺伝子変異を調べたところ、その1.9%にRET融合遺伝子を認めました。
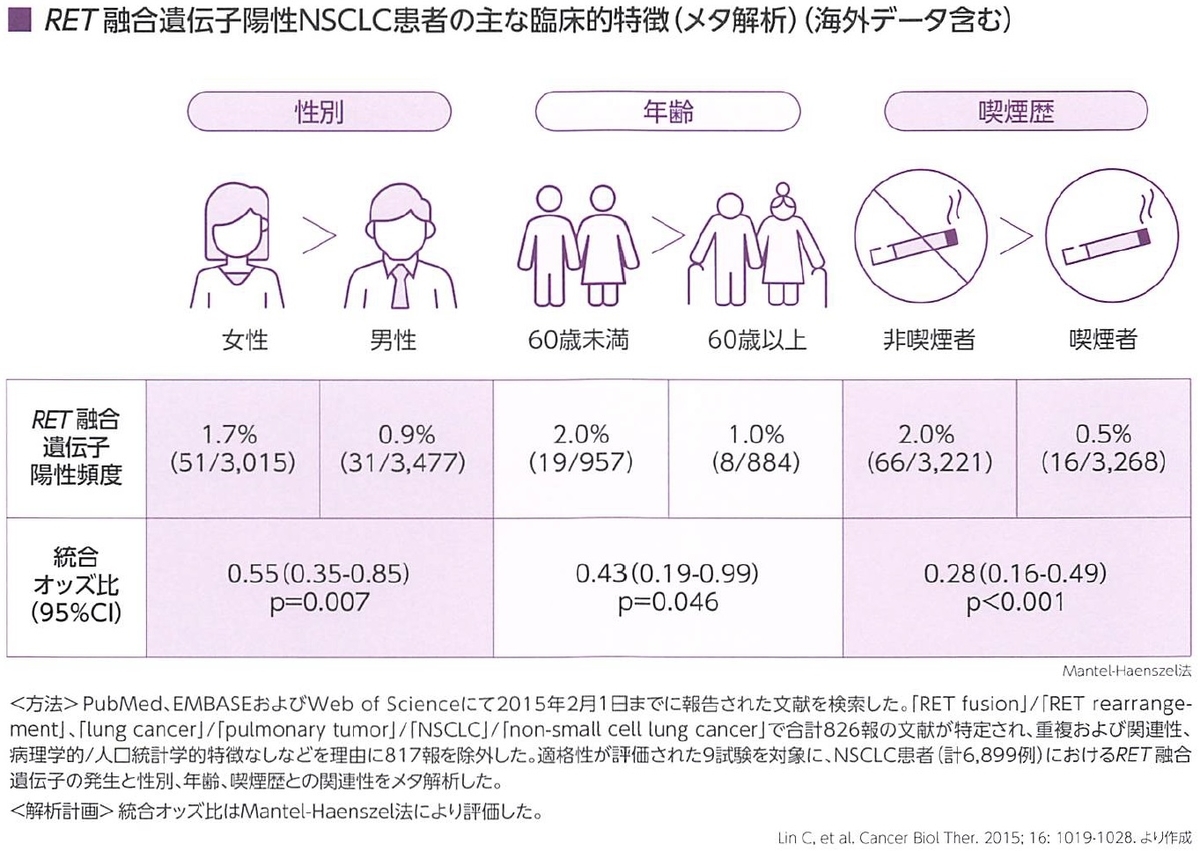
過去の論文から6899人の肺がん患者データを抽出して調査したところ、
1)女性
2)60歳未満
3)非喫煙者
では統計学的有意にRET融合遺伝子陽性肺がんの患者が多かったようです。

RET融合遺伝子陽性肺がんは、EGFR、ALK、ROS1、BRAF各遺伝子異常と同じく、オンコマインDxTT(デラックスターゲットテスト)マルチCDx(コンパニオン診断)システムで検出できます。 

LIBRETTO-001試験は、RET融合遺伝子陽性固形がんの患者を対象とした臨床試験で、推奨用量設定のための安全性確認試験である第I相部分と、主要評価項目を奏効割合とした有効性確認試験である第II相部分に分かれていました。今回薬事承認の根拠となったのは、第I相部分および第II相部分のコホート1、コホート2における非小細胞肺がん患者のデータです。

コホート2の未治療群では、総数49人中、日本人はわずか4人しか含まれていません。一方、コホート1の既治療群では、総数210人中日本人は44人と20%を超えるプレゼンスを示します。既治療群において、95%は化学療法の、60%は抗PD-1 / PD-L1薬の治療歴がありました。 

第I相部分、第II相部分の統合解析では、主要評価項目の奏効割合は、未治療群では70.5%(95%信頼区間54.8-83.2)、既治療群では56.9%(95%信頼区間49.8-63.8)でした。

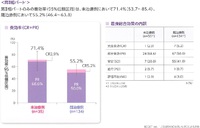 推奨用量に則った治療を受けた第II相部分の患者だけを解析すると、主要評価項目の奏効割合は、未治療群では71.4%(95%信頼区間53.7-85.4)、既治療群では55.2%(95%信頼区間46.4-63.8)でした。
推奨用量に則った治療を受けた第II相部分の患者だけを解析すると、主要評価項目の奏効割合は、未治療群では71.4%(95%信頼区間53.7-85.4)、既治療群では55.2%(95%信頼区間46.4-63.8)でした。 

最良変化率のwaterfall plotを見ると、未治療例、既治療例ともに、ほぼすべての患者で腫瘍縮小効果が得られています。 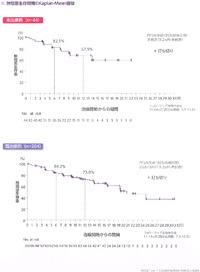

無増悪生存期間中央値は、未治療群では未到達(95%信頼区間9.2-未到達)、既治療群では20.67ヶ月(95%信頼区間19.3-未到達)でした。 

全生存期間中央値は、未治療群では未到達(95%信頼区間算定不能)、既治療群でも未到達(95%信頼区間25.7-未到達)でした。 

中枢神経系の測定可能病変があった患者集団では、治療によるその奏効割合は82%で、最良効果判定が病勢進行とされた方は1人も認めませんでした。 

本試験全体(非小細胞肺がん以外の固形癌患者も含む)としての有害事象は高頻度に認め、肝障害、QT延長、高血圧が多かったようです。また、本治療薬に特徴的な有害事象として過敏症関連事象が取り上げられています。発熱、発疹、肝機能障害、血小板減少が現れたら要注意で、休薬とプレドニゾロン0.5-1.0mg/kg程度の内服治療が初期対応とされます。間質性肺炎の出現頻度は1.2%とわずかで、Grade 3以上の重篤なものはありませんでした。 _1-s.jpg)



こちらは、日本人において、発現頻度が10%を超える有害事象の一覧です。 

こちらは、日本人において、発現頻度が20%を超える有害事象の一覧です。
肝機能障害がかなりの高頻度で認められており、定期的な血液検査が欠かせません。

 免疫チェックポイント阻害薬の治療歴があると、過敏症発現頻度が10%強まで高まるようです。二次治療以降で本治療薬を使用される方のほとんどが免疫チェックポイント阻害薬の使用歴があると予想されますので、注意を要します。
免疫チェックポイント阻害薬の治療歴があると、過敏症発現頻度が10%強まで高まるようです。二次治療以降で本治療薬を使用される方のほとんどが免疫チェックポイント阻害薬の使用歴があると予想されますので、注意を要します。




-s.jpg)